科学家建立邻近细胞遗传学技术揭示体内细胞间相互作用
来源:中国科学院分子细胞科学卓越创新中心
12月2日,《科学》(Science)以Research Article的形式,在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的最新成果(Monitoring of cell-cell communication and contact history in mammals)。该研究基于合成生物学结合体内遗传学技术,开发了可以捕捉体内细胞间相互作用并能够永久追踪邻近细胞的创新研究工具——邻近细胞遗传学技术。利用该技术,科研人员揭示了心脏内皮细胞在早期胚胎发育过程中迁移到肝脏并转变成为肝血窦内皮细胞,以及在肿瘤生长过程中肿瘤血管内皮细胞迁移到肿瘤外包膜的现象,这推进了关于体内细胞间相互作用的研究。
细胞之间的交流和相互作用是维持生物体生命活动有序进行的必要条件,解析细胞之间的相互作用对于探索多种生物学过程及调控机制具有重要意义。近30年来,科学家利用传统的遗传示踪、组织特异性基因敲除或过表达等技术,只能针对特定细胞自身进行细胞或分子水平的操作,剖析细胞之间的相互作用颇具挑战。因此,亟需建立新的遗传操作技术,实现体内监测与记录细胞之间相互作用,为推动细胞生物学、遗传学及再生医学等领域的发展提供新的强有力工具。
Notch信号通路是细胞之间交流的经典信号通路。以往报道将其改造并加入人工调控元件,用来探究细胞之间的相互作用(Morsut et al., Cell 2016)。在两个细胞中分别表达人工合成的Notch配体和受体蛋白后,当细胞相互接触时,受体和配体特异性结合,引起受体跨膜段的构象改变;γ-secretase将切断受体跨膜段和胞内段的连接,释放胞内段的人工合成遗传元件,如转录调控因子Gal4、tTA等,这些遗传元件可以进入细胞核内调控下游基因的表达。该技术称为人工合成Notch信号通路——Synthetic Notch(synNotch)。
周斌研究组长期致力于小鼠体内遗传学技术的开发与应用。本研究经过探索和优化,建立了检测体内细胞之间相互作用的新技术——邻近细胞遗传标记技术。研究以心脏中心肌细胞和内皮细胞为例,证明该技术可在体内将细胞接触信息转变为遗传信号。研究将心肌细胞作为synNotch信号发送细胞、内皮细胞作为synNotch信号接收细胞,分别构建了心肌细胞特异性表达synNotch配体的工具小鼠Tnnt2-mGFP,以及内皮细胞特异表达synNotch受体的工具小鼠Cdh5-αGFP-N-tTA(Cdh5-GFP nanobody-Notch transmembrane domain-tTA)。在Tnnt2-mGFP;Cdh5-αGFP-N-tTA;tetO-nLacZ小鼠中,当未发生细胞接触时,synNotch受体的酶切位点被隐藏在特定蛋白区域内;当细胞相互接触时,心肌细胞膜表面的GFP蛋白和内皮细胞膜表面的GFP抗体特异性结合,激活synNotch信号通路,受体胞内段的tTA进入内皮细胞的细胞核中并结合tetO转录调控序列,激活报告基因nLacZ的表达,显示出与心肌细胞接触的内皮细胞,验证了该技术的可行性。为了更加方便荧光成像和细胞分选,研究引入了tetO-tdT荧光报告基因小鼠,更直观地展现心肌细胞和内皮细胞之间的接触。上述研究证明了邻近细胞遗传标记技术的成功建立。此外,该工作证明这一技术同样适用于其他组织中细胞相互作用的研究。
邻近细胞遗传标记技术可以反映细胞之间的实时接触信息,提升了细胞间相互作用的研究水平和精度。然而,当细胞分开后,synNotch停止激活,细胞膜上的tTA将不再入核;同时,由于蛋白代谢,游离的tTA以及报告蛋白会逐渐减少,受体细胞将很快失去报告蛋白标记。那么,如何实现体内邻近细胞的永久追踪?
为了使synNotch的瞬时激活转变为永久性的遗传改变,研究引入了Cre-loxP同源重组系统。当Cre-loxP发生同源重组后,两个loxP之间的终止序列被切除,报告基因可以永久性地表达。研究在synNotch技术中引入tetO-Cre;R26-tdT,实现永久记录细胞之间的相互作用。与tetO-nLacZ、tetO-tdT类似,tetO-Cre工具小鼠受到tTA的调控,表达出Cre重组酶。受体和配体细胞相互接触后激活synNotch信号通路,诱导受体细胞表达Cre,从而使受体细胞被永久示踪。该技术称作邻近细胞遗传示踪技术。研究以心肌细胞作为配体细胞(Tnnt2-mGFP)、内皮细胞作为受体细胞(Cdh5-αGFP-N-tTA),利用该技术对与心肌细胞接触过的内皮细胞进行永久示踪。在小鼠胚胎早期,心内膜内皮细胞与心肌细胞紧密接触;从胚胎9.0天到出生后,心内膜内皮细胞来源的房室垫逐渐重塑形成心脏瓣膜,同时,瓣膜中心内膜来源的间充质细胞不仅远离心肌细胞,而且不表达Cdh5基因,而研究显示,这些间充质细胞持续表达tdTomato,证明曾经接触过心肌细胞的内皮细胞及其子代细胞都经历过Cre-loxP介导的遗传操作,被永久性示踪标记。此外,研究发现示踪的心脏内皮细胞在早期胚胎发育过程中会迁移到肝脏,转变成为肝脏特有的肝血窦内皮细胞。
细胞间的相互作用还与各种疾病发生发展密切相关。以肿瘤为例,在肿瘤发生过程中,肿瘤细胞招募周围组织中的血管迁移至肿瘤,受到肿瘤环境影响,肿瘤血管与正常血管相比具有显著差异。科研人员利用新开发的邻近细胞遗传学技术探究肿瘤细胞和内皮细胞之间的相互作用。研究将过表达mGFP的TC-1肿瘤细胞系皮下移植到受体小鼠Cdh5-αGFP-N-tTA;tetO-Cre;R26-tdT中。研究观察到几乎全部的肿瘤血管内皮细胞都被标记上tdTomato,并通过长时程追踪发现,肿瘤血管内皮细胞会迁移到肿瘤外包膜。这部分迁出肿瘤的血管内皮细胞具有典型的转移和浸润、促血管生成以及炎症反应等特征。上述成果为肿瘤的研究治疗奠定了一定的理论基础。
基于以上实验结果,为了拓展邻近细胞遗传学的应用范围,研究人员构建了由Cre重组酶诱导表达synNotch配体的小鼠R26-mGFP。搭配特定细胞类型的Cre小鼠品系,通过Cre-LoxP重组,特异性地使该类型细胞表达mGFP,成为配体细胞。同时,科研人员构建了由Cre诱导表达synNotch受体的小鼠H11-αGFP-N-tTA,结合Cre小鼠使特定类型细胞表达αGFP-N-tTA,成为受体细胞。
进一步,研究对该系统进行改造优化以提高可用性。研究将序列tetO-rox-stop-rox-tdT-insulator-CAG-loxP-αGFP-N-tTA-pA-loxP-mGFP插入到小鼠基因组Tigre位点,构建了Tigre-synNotch小鼠。在该小鼠中,所有细胞都会表达αGFP-N-tTA,成为受体细胞。当搭配特定Cre小鼠时,Cre重组酶会在基因组上切掉αGFP-N-tTA-pA序列,使Cre阳性的细胞表达mGFP,成为配体细胞。所有Cre阴性的细胞保持着受体细胞的状态,因此,研究能够利用Tigre-synNotch标记与特定细胞接触的所有其他细胞。
综上,该研究的亮点在于开发了可以捕捉体内细胞间相互作用并能够永久追踪邻近细胞的创新研究工具——邻近细胞遗传学技术。该技术具有较高的可调控性、简易性和普适性,以全新的视角直观展现了体内细胞间的动态相互作用。这一新技术突破了传统的细胞示踪方法,将体内细胞示踪和遗传学研究提升到新的维度,为发育生物学、干细胞生物学、免疫学和肿瘤学等领域研究提供了新的研究思路和强大技术支撑。
研究工作得到中科院、国家自然科学基金、科技部、上海市科学技术委员会,以及分子细胞卓越中心动物平台和细胞分析技术平台等的支持。

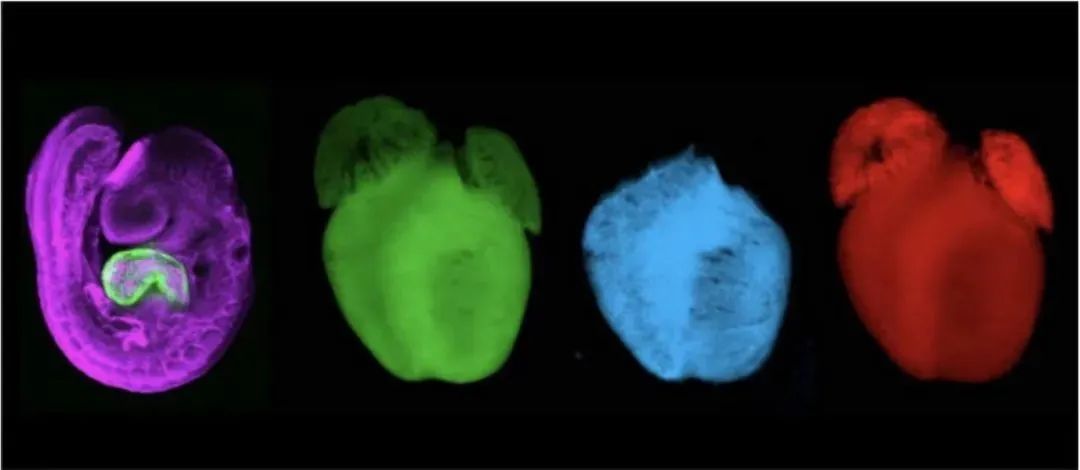
(i)小鼠胚胎中心肌细胞表达synNotch配体(绿色),内皮细胞表达synNotch受体(紫色)。(ii-iv)新生小鼠心脏中,表达synNocth配体的心肌细胞(绿色,ii),利用邻近细胞遗传标记技术捕捉实时接触心肌细胞的内皮细胞(蓝色,iii),利用邻近细胞遗传示踪技术追踪接触过心肌细胞的内皮细胞(红色,iv)。
未来智能实验室的主要工作包括:建立AI智能系统智商评测体系,开展世界人工智能智商评测;开展互联网(城市)大脑研究计划,构建互联网(城市)大脑技术和企业图谱,为提升企业,行业与城市的智能水平服务。每日推荐范围未来科技发展趋势的学习型文章。目前线上平台已收藏上千篇精华前沿科技文章和报告。
如果您对实验室的研究感兴趣,欢迎加入未来智能实验室线上平台。扫描以下二维码或点击本文左下角“阅读原文”

关注公众号:拾黑(shiheibook)了解更多
[广告]赞助链接:
四季很好,只要有你,文娱排行榜:https://www.yaopaiming.com/
让资讯触达的更精准有趣:https://www.0xu.cn/
 关注网络尖刀微信公众号
关注网络尖刀微信公众号随时掌握互联网精彩
- 1 从“水之道”感悟“国之交” 7903985
- 2 台当局被曝和日本出现军事勾连迹象 7809448
- 3 1818名明星网红等人查补税款15.23亿 7714341
- 4 全国冰雪季玩法大盘点 7616701
- 5 泰国总理:做好一切准备维护国家主权 7520241
- 6 周星驰《鹿鼎记》重映首日票房仅18万 7424388
- 7 净网:网民造谣汽车造成8杀被查处 7328518
- 8 外交部回应普京对中印关系评论 7233846
- 9 日方挑衅中国收割民意非常危险 7140283
- 10 流感自救抓住“黄金48小时” 7042317







 人工智能学家
人工智能学家







